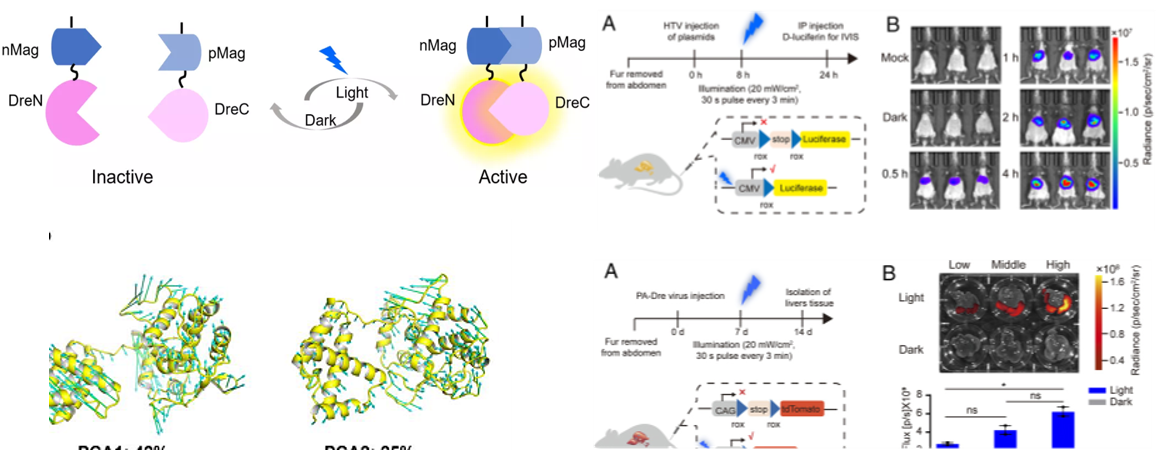
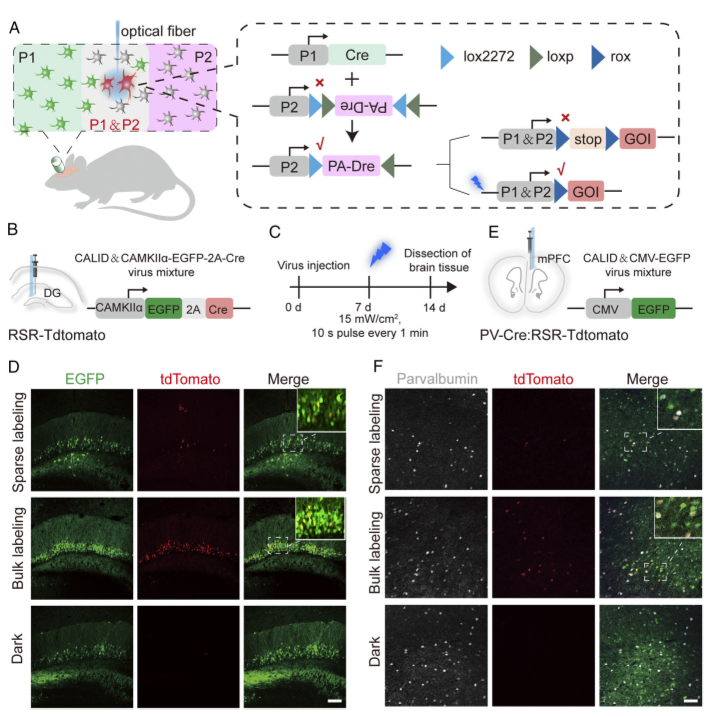
在動物體內特定的細胞群體中進行時空特異性的細胞標記和基因操作一直是生物學研究的技術難題。位點特異性重組酶,尤其是基于Cre重組酶而開發的各種誘導型重組酶系統被廣泛用于細胞標記和基因功能研究。其中光誘導的Cre重組酶系統不僅安全、易調節且具有高度的時空分辨率。然而單個重組酶系統具有一定的局限性,很難用于解析復雜的細胞網絡,尤其是神經系統。本文旨在構建光激活的Dre重組酶(photoactivatable Dre,PA-Dre)系統及Cre激活的光誘導Dre(Cre-Activated Light Inducible Dre,CALID)系統并在小鼠體內和腦內特定的細胞群體中實現時空特異性的基因調控。
研究將蛋白質動態構象理論計算與光遺傳學相結合,開發出了高效、嚴格受藍光調控的光激活Dre重組酶系統(photoactivatable Dre,PA-Dre)并結合組織特異性Cre構建了由藍光和Cre雙調控的新型光誘導Dre重組酶系統,命名為Cre激活的光誘導Dre(CALID)系統,該系統不僅能在細胞上高效嚴謹地調控基因表達,還可在小鼠的肝臟和腦部靈活地調控內源基因的表達。
我們相信已有的Cre轉基因小鼠與光誘導Dre重組酶系統結合將有助于闡明各研究領域中復雜的生物學問題,為基因編輯領域增加了新工具,為其后續研究開辟新途徑。該論文在2020年12月14日在《PNAS》雜志上發表(DOI: https://doi.org/10.1073/pnas.2003991117)。